氢原子与碱金属原子
氢原子
氢原子的定态 Schrodinger 方程
- 定态 Schrodinger 方程:
- Laplace 算子:
- 分离变量:
- 方位角部分:
- 极角部分:
- 径向部分:
- 波函数:
三个量子数的物理意义
主量子数 $ n $ 和能级:
(1) $\hat{H}$ 的本征方程:(2) 能级:
(3) 能级的简并度(同一能级,氢原子有$n^2$个本征态):
角量子数 $ l $ 和轨道角动量:
(1) $\hat{L}^2$ 的本征方程:(2) 轨道角动量的大小:
磁量子数 $ m $ 和轨道角动量空间取向:
(1) $\hat{L}_z$ 的本征方程:(2) 轨道角动量 $ z $ 分量的大小:
电子概率密度分布
空间概率分布:
角向概率分布:
径向概率分布:
$P_{nl}(r)$ 有 $ n - l $ 个极大值点,$ n - l - 1 $ 个极小值点。主峰位置随 $ l $ 增加向原子核移近。$ l $ 值越小,最内层的峰离核越近,说明对同一 $ n $ 值,随着 $ l $ 的减小,电子出现在原子核附近的概率逐渐增大。
电子径向坐标的平均值:
定态的宇称
空间反演算符:
氢原子定态的宇称取决于 $ l $:
跃迁的选择定则
感生偶极矩算符:
电偶极跃迁矩阵元:
在 $ \psin(r) $ 和 $ \psi{n’}(r) $ 间发生跃迁的概率正比于 $ |D_{nn’}|^2 $。
发生电偶极辐射跃迁的条件
(1) 方位角部分:
磁量子数的选择定则:
(2) 极角部分:
角量子数的选择定则 (Laporte 选择定则):
碱金属原子
碱金属原子能级的粗结构:
(1) 对同一主量子数 $ n $,碱金属能级位置低于氢原子。
(2) 对同一主量子数 $ n $,不同角量子数 $ l $ 导致能级分裂。碱金属原子能级低于H的原因:
(1) 原子实极化:价电子对原子实有极化作用。
(2) 轨道贯穿:价电子有一定概率出现在原子实内。原子实的有效电荷数$𝑍^∗ > 1$,使得碱金属原子能量降低.(用量子力学的观点就是价电子的波函数在原子实内部不为零)
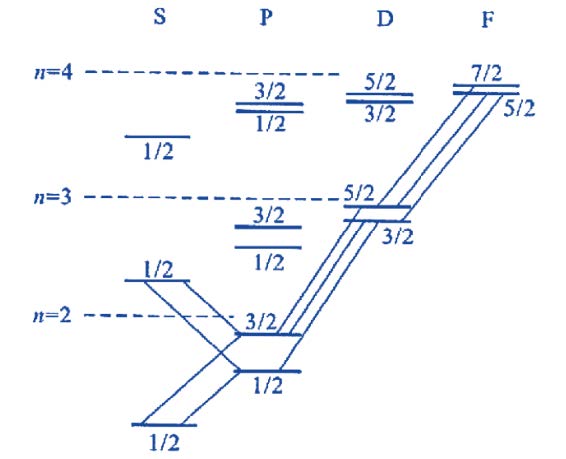
碱金属原子的能级和光谱项:
不同能级之间的跃迁遵守电偶极跃迁规则. 跃迁前后角量子数𝑙 的变化满足Δ𝑙 = ±1. 图中由𝑛𝑝 向2𝑠 跃迁的,即𝑛𝑝 → 2𝑠 为主线系,𝑛𝑠 → 2𝑝 为第二辅线系,𝑛𝑑 → 2𝑝为第一辅线系,𝑛𝑓 → 3𝑑 为柏格曼系. 2𝑝 向基态2𝑠 的跃迁产生的谱线称为共振线.
电子的自旋与磁矩
电子轨道的磁矩
电子轨道的磁矩:
电子轨道的磁矩的大小:
电子轨道的磁矩 $ z $ 分量的大小:
Stern-Gerlach 实验
作用于原子磁偶极矩上的力:
横向位移:
电子自旋的磁矩
电子自旋角动量量子数:
电子自旋角动量:
(1) 电子自旋角动量的大小:(2) 电子自旋角动量 $ z $ 分量的大小:
电子自旋的磁矩:
(1) 电子自旋磁矩和自旋角动量的关系:(2) 电子自旋磁矩的大小:
电子轨道和自旋磁矩的公式:
电子量子态的波函数:
碱金属原子光谱的精细结构
原子的总角动量
原子的总角动量:
总角动量的大小:
总角动量 $ z $ 分量的大小:
$\mathcal{LS}$ 耦合不改变碱金属原子量子态的数目:
自旋-轨道相互作用
自旋 − 轨道耦合 使得 同一l能级进一步分裂为两个值 (能级精细结构)
j 值大的能级高, j 值小的能级低
s 态不分裂
原子实在电子处产生的磁感应强度:
在原子实静止系中,Thomas 给出右面应乘 1/2:
自旋-轨道耦合能:
自旋-轨道耦合能在原子定态中的平均值:
碱金属原子光谱的精细结构
碱金属原子总能量:
双重能级:
双重能级间隔:
波数间隔:
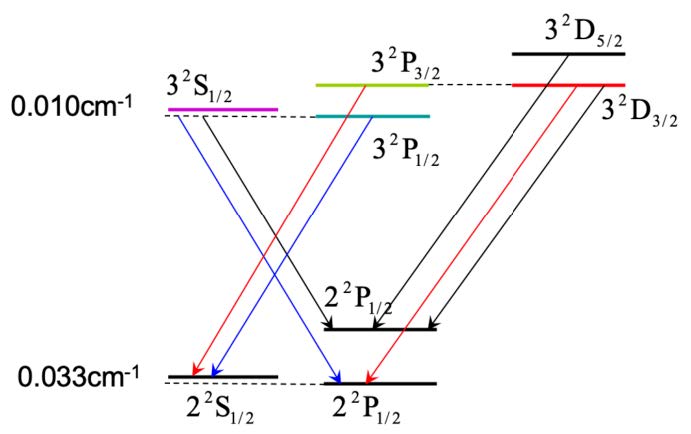
精细能级跃迁的选择定则:
原子能级符号:
图 1: 锂原子能级能级的精细结构及允许跃迁
碱金属原子能级精细结构的几个特点:
- 双重能级分裂的大小与有效核电荷数$𝑍^∗$ 的四次幂成正比,随着原子序数的增大,$𝑍^∗$ 也增大,所以高原子序数$Z$ 的原子双重能级分裂大.
- $n^2 S_{1/2}$能级不存在精细分裂,因为$𝑙 = 0$ 时,不存在轨道运动产生的磁场,但通常
仍保留多重数为2 的标记.S- $Δ𝐸_{𝑙𝑠}$ 反比于$𝑛^3$ 和$𝑙^3$,对同一原子,随着量子数𝑛 及𝑙 的增大,精细分裂迅速减小.
- 双重能级中,具有较高$J$ 值的能级,能量较高.